Клеточный феномен "0.3 - 0.8"
 Изучение клеточного материала по его морфологической картине, составляет задачу объективного разграничения биологического субстрата по комплексу признаков. Проблема считается решенной, если построен метод выбора комбинации признаков, обеспечивающих различение между разделяемыми объектами, и исключены неинформативные комбинации. Эта задача, типичная для теории распознавания образов, типична также и в онкологии, поскольку определение группы решающих признаков, позволяет сосредоточить основное внимание на тех, которые несут максимальную информацию.
Изучение клеточного материала по его морфологической картине, составляет задачу объективного разграничения биологического субстрата по комплексу признаков. Проблема считается решенной, если построен метод выбора комбинации признаков, обеспечивающих различение между разделяемыми объектами, и исключены неинформативные комбинации. Эта задача, типичная для теории распознавания образов, типична также и в онкологии, поскольку определение группы решающих признаков, позволяет сосредоточить основное внимание на тех, которые несут максимальную информацию.
Для биоматематиков и онкологов
В связи с этим, чрезвычайно важно выявление наиболее информативных признаков, в частности, связанных с обычно наблюдаемыми и измеряемыми показателями ядра и цитоплазмы и введением меры на них. Для отражения динамики на клеточных полях, необходимо использовать такие признаки, которые могут не только выявлять их качественные изменения, но отображать их в цифре, и при этом, быть достаточно чувствительными к их малым сдвигам. Для решения такой задачи, в силу природы клеточного поля, может быть выбрана вероятностная мера для отражения сходства и естественно-технологическая мера, для установления отношений равенства и порядка его элементов. Вероятностная мера, в частности, позволяет отобразить динамику естественно-технологического процесса озлокачествления.
Мера на отношениях равенства и порядка, позволяет отобразить динамичность кинетических процессов размножения клеточных множеств. Отношения соответствия и взаимного отражения этих мер, означают, что размытость феномена клеточного поля элиминируется четкой мерой равенства и порядка.
Мы уже описали обобщенный показатель, статистический по своей природе, отражающий динамические механизмы малых морфологических сдвигов на множествах клеток — феноменологию роста опухоли, чрезвычайно сложную и трудно трактуемую, особенно на начальных этапах возникновения злокачественного роста. Его определению предшествовало выявление численных значений разделяющих признаков состояния отдельных клеток — ядерно-цитоплазматических констант ЯЦК, обладающих с одной стороны, свойством разделения наблюдаемого множества клеток эпителиального поля на подмножества по их текущим, на малых интервалах сдвигам состояния и, с другой стороны — инвариантностью к изменениям динамики таких сдвигов. Для понимания вероятностной природы таких констант, необходимо рассмотреть используемый материал, методику его получения и некоторые результаты исследования естественно-технологических процессов озлокачествления, отражающиеся на уже рассмотренных графах и представлениях древесного роста.
Основным материалом для накопления исходных данных явился эпителий шейки матки, как более доступный для исследования, а в сопоставительном анализе, также субстрат желудка и легких (его получение проводилось с помощью смывных вод), кожи, ЛОРорганов, губы, молочной железы и многих других локализаций. Получение и подготовка материала, обеспечение его однородности и меры предосторожности, в том числе — параллельный контроль в эксперименте на животных, осуществлялись стандартными методами. Для получения моделей применялся гистологический материал с толщиной срезов 5 мк. Использование гистологических срезов позволило производить измерения, более точные, по сравнению с цитологическими препаратами. Для построения математических моделей клеточных полей, отражающих этапы раннего озлокачествления, именно гистологические срезы позволяют более подробно учесть отношения между паренхимой и стромой.
Для получения генеральной совокупности было отобрано 50000 клеток, состояния которых были верифицированы всеми доступными для исследователя средствами. Для ее формирования, в каждом из 500 использованных препаратов, измеряли по 100 клеток, при этом брали одинаковое число клеток в поверхностном, промежуточном и базальном слоях эпителия. Для получения более представительных оценок ядерно-цитоплазматического индекса (ЯЦИ) ранних состояний озлокачествления (Ca in situ), особенно при самых малых сдвигах, была использована случайная выборка из генеральной совокупности в 4000 клеток, а при инвазивном раке — в 1600 клеток. Для вычисления вероятностных характеристик ЯЦИ нормального многослойного эпителия, была взята выборка в 3000 клеток. Значение индекса определялось как отношение объемов ядра и клетки, измерения линейных размеров производились с помощью окуляр-микрометра, величина деления которого составляла 3 мк при постоянной оптической системе микроскопа. На множествах найденных значений ЯЦИ, с целью оценки устойчивости распределений относительно объемов выборок, методом рандомизованного поиска, производились частные выборки различной мощности по каждому из состояний — нормы, пластического и гиперпластического роста. Таким образом, модели строились на обезличенном материале.
При определении ЯЦИ нормального многослойного эпителия рассматривались клетки в состоянии покоя, причем измерялось одинаковое количество клеток поверхностного, промежуточного (шиповидного) и базального слоев. Максимальное количество клеток эпителия в норме, без учета послойного разделения, имеет ядерно-цитоплазматического отношения, равное 0.13+-0.015. Послойные измерения показали, что максимальное количество клеток поверхностного слоя имеет значение ядерно-цитоплазматического отношения равное 0.05, промежуточного 0.1, базального 0.25, т.е. ядерно-цитоплазматическое отношение по мере приближения к поверхности многослойного плоского эпителия уменьшается. Особое внимание уделялось местам разграничения нормального, пластического, гиперпластического и ракового эпителия.
Было установлено, что при внутриэпителиальном раке (в частности шейки матки), когда нормальная выстилка эктоцервикса на значительном протяжении замещается атипичным эпителием, цитологически идентичным с изменениями многослойного эпителия при инвазивном раке, максимальное число клеток имело значение ЯЦИ близкое к 0.8. Четкость границы между карциноматозным и нормальным многослойным эпителием позволила учесть постепенное нарастание атипизма в базальном слое и уточнить задачу исследования малых приращений сдвигов в динамике процесса.
При изучении клеток пластического эпителия и пограничного ракового эпителия, определение и сравнение ЯЦИ отдельных клеток производилось также послойно, в каждом из пограничных слоев эпителия. Это оказалось более сложным из-за того, что в дисплазионном (в меньшей мере) и в раковом (в большей мере) слоях, нарушена архитектоника эпителия. Оказалось, что наибольшему числу клеток в поверхностном слое дисплазионного эпителия, соответствует значение ЯЦИ, близкое справа к 0.15, в шиповидном к 0.25, а в базальном к 0.45. В раковом эпителии эта величина оказалась равной 0.8. Характерно, что в базальном слое ракового эпителия, чаще, чем в поверхностном слое, встречались клетки с ядерно-цитоплазматическим отношением, равным 0.9 и 1.0 (голые ядра). В случае базальной гиперактивности с переходом в атипичную базальную гиперактивность и внутриэпителиальный рак, наблюдалось постепенное нарастание атипизма клеток в базальном слое Оно сопровождалось сдвигом ядерно-цитоплазматического отношения вправо, со значения 0.3 до значения 1.0. Все цитологические измерения проделаны доктором медицины Борисом Каплан.
Такое распределение клеток в пространстве биологического субстрата, позволяет формально уточнить понятие состояния дисплазии, выделив в нем подсостояния пластичности, при которых клетки обладают его повышенным значением, приближающимся к величине 0.3 слева и гиперпластичности — для клеток этого же состояния, но удаляющихся вправо от этого значения, в сторону его увеличения.
Визуально наблюдаемый феномен, в виде образа клеточного множества, представляет собой случайное "замороженное" множество элементов размытой конфигурации, случайно расположенных на плоскости предметного стекла, группирующихся в случайные подмножества, часто с размытыми, нечетко выраженными границами. Элементы этого множества находятся в отношениях сходства, равенства и порядка, отражая динамичность изменения клеток в живом субстрате на момент изъятия из него образца. Наблюдаемый облик замороженной клетки отражает все невидимые наблюдателю процессы, происшедшие в ней. Следовательно, этот облик, неся информацию о состоянии клетки, идентифицируется значением ядерно-цитоплазматического индекса, вероятностные характеристики значений которого, по всему клеточному полю, определяются текущим состоянием клеточного субстрата.
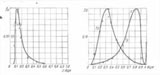 Плотности вероятностей ядерно-цитоплазматического индекса для нормального, дисплазионного и ракового состояний эпителия, показаны на рисунке. Характерные для большинства клеток эпителия значения ЯЦИ — моды распределения, однозначно отражают нормальное состояние, переход из пластического к гиперпластическому состоянию и состояние озлокачествления. Характер этих кривых отражает отношение "часть-целое" между клетками, как взаимосвязь предмета — состояния субстрата, и образующих его элементов.
Плотности вероятностей ядерно-цитоплазматического индекса для нормального, дисплазионного и ракового состояний эпителия, показаны на рисунке. Характерные для большинства клеток эпителия значения ЯЦИ — моды распределения, однозначно отражают нормальное состояние, переход из пластического к гиперпластическому состоянию и состояние озлокачествления. Характер этих кривых отражает отношение "часть-целое" между клетками, как взаимосвязь предмета — состояния субстрата, и образующих его элементов.
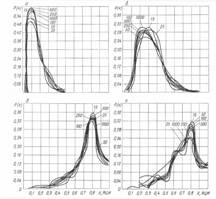 Эти характерные, для нормального, дисплазионного состояния, рака в эпителии и инвазивного рака, зависимости, слабо зависят от мощности выборки клеток (от 25 до 1000) и независимы от локализации опухоли. К сожалению, ранее при изучении статистических свойств ЯЦИ, эти значения замечены не были и их свойства оставались не изученными.
Эти характерные, для нормального, дисплазионного состояния, рака в эпителии и инвазивного рака, зависимости, слабо зависят от мощности выборки клеток (от 25 до 1000) и независимы от локализации опухоли. К сожалению, ранее при изучении статистических свойств ЯЦИ, эти значения замечены не были и их свойства оставались не изученными.
Третья группа графиков отражает распределения, полученные экспериментально на животных: модель и опухоли карциномы Брауна-Пирс, метастазы в брюшную полость, метастаз в лимфоузел; модель и карциномы Герена, подкожная опухоль, метастаз в почку. Эти распределения неотличимы от распределений, полученных для человека.
Плотности вероятностей, как частости значений ЯЦИ, отражают своими модами три его состояния: NORMAL (эпителиальная константа, ЯЦК0.13), пластическое Promotion (дисплазионная константа, ЯЦК0.30), переходящее в гиперпластическое состояние активного роста Progression (раковая константа ЯЦК0.8). Плотности вероятностей могут быть использованы для оценки динамики механизмов статистических, на множествах клеток, преобразований в естественно-технологическом процессе озлокачествления.
 Для спокойного состояния эпителия, значение эпителиальной константы характерно для 60% клеток. Дисплазионная константа в пластическом эпителии, не перешедшем в гиперпластический, характерна для 36% клеток. Это же число клеток сохраняется относительно раковой константы канонизированного процесса. Завершенность процесса характеризуется относительным количеством в 13% озлокачествленных клеток, перешедших в состояние "голого ядра" с ЯЦИ равным единице. Единичные малигнизированные клетки, как центры группирования, появляются одновременно с появлением клеток состояния пластичности.
Для спокойного состояния эпителия, значение эпителиальной константы характерно для 60% клеток. Дисплазионная константа в пластическом эпителии, не перешедшем в гиперпластический, характерна для 36% клеток. Это же число клеток сохраняется относительно раковой константы канонизированного процесса. Завершенность процесса характеризуется относительным количеством в 13% озлокачествленных клеток, перешедших в состояние "голого ядра" с ЯЦИ равным единице. Единичные малигнизированные клетки, как центры группирования, появляются одновременно с появлением клеток состояния пластичности.
Такие соотношения отражают целый ряд порожденных ими событий. Эти события, как явления на клеточном множестве, удобно обсудить на отображениях древесного роста. При достижении ядерно-цитоплазматическим отношением значения 0.55, при котором число клеток гиперпластического подсостояния состояния дисплазии, достигает 13%, возникает состояние активного озлокачествления — гиперплазия, при котором происходит резкое возрастание его значения до значения раковой константы равной 0.8, резко обрывающееся и образующее в точке x1.0 скачок, имеющий характер дельта-функции, — функции, равной нулю при всех значениях аргумента кроме того, при котором она, превращаясь в бесконечность, может масштабироваться. Площадь ее равна единице. В нашем случае она определена в точке образования голых ядер, т.е. в точке x0=1.
 Клиническая практика полностью согласуется с приведенными данными (см. 4-ю группу графиков, где внутриэпителиальный и инвазивный рак показаны раздельно). Отсутствие, или незначительное количество клеток со значением ЯЦИ в интервале между 0.8 и 1.0, свидетельствует об их скачкообразном обращении в "голое" ядро ("раковый взрыв"). Это отражает гибель клетки при значении ЯЦИ, уже незначительно превышающем значение раковой константы.
Клиническая практика полностью согласуется с приведенными данными (см. 4-ю группу графиков, где внутриэпителиальный и инвазивный рак показаны раздельно). Отсутствие, или незначительное количество клеток со значением ЯЦИ в интервале между 0.8 и 1.0, свидетельствует об их скачкообразном обращении в "голое" ядро ("раковый взрыв"). Это отражает гибель клетки при значении ЯЦИ, уже незначительно превышающем значение раковой константы.
Для оценки механизмов порождения и развития процессов активного роста Progression на вероятностной мере, важным является зеркальный характер распределения частостей значений ЯЦИ клеток этого состояния, относительно аналогичной кривой состояния Promotion при значении равном 0.55 и, при совпадении по форме нисходящей ветви распределения Promotion (см.рис.) с восходящей ветвью состояния Progression. Это отражение известного в биологии феномена "левизны-правизны", статистическое на уровне клетки. Природа такого зеркального отражения связана с активацией агрессивных механизмов карциногенеза. Значение ЯЦИ, равное 0.55 отражает статистический параметр феномена — константу обращения.
Модельные плотности распределения, показанные на первом рисунке, аппроксимировались аналитически. Это позволило решить интегральное уравнение идентификации (типа Вольтерра II рода), и найти вид операторов преобразования плотностей вероятности и их параметры в линейном приближении. При этом оказалось, что экспериментально определенные плотности вероятностей с высокой степенью точности аппроксимируются кривыми распределения Пирсона типа III (без учета дельта-функции распределения при раке, отражающей множество голых ядер). Оказалось, также, что аналитическое выражение распределения частостей инвариантно к виду кривой, отображающей состояния субстрата, изменяя в зависимости от него лишь свои показатели. Это отражает статистическую однородность ЯЦИ на всем протяжении процесса преобразований, а, следовательно, и единство порождающих его процессов.
С другой стороны, изучение множества численных показателей распределений показывает, что их изменение есть отражение изменений переключающего характера межклеточных взаимодействий, направленных на достижение специфических целей различными, распределенными в пространстве биологического субстрата, подмножествами клеток, изменивших свою функциональную ориентацию. Это подтверждает также и феномен зеркального отражения статистической правизны, относительно состояния Promotion, предшествующего возникновению агрессивного роста — Progression. Совокупность взаимосвязанных процессов, происходящих в биологическом субстрате, отражается в динамические изменения, порождающие на интервале [0.3-0.8] ЯЦИ те изменения ядерно-цитоплазматического индекса, которые отражаются статистикой клеточного феномена и составляют его. На решетке клеточных множеств, зарождение этого феномена отражается узлом возбуждения, фиксирующим образование клеточного множества баланса эквивалентности, а на дереве роста — узлом ветвления, порождающим стволы роста состояния PROMOTION и PROGRESSION.
Заметим, что на приведенных вероятностных характеристиках, текущее время выступает в качестве параметра, фиксируемого как момент наблюдения. Ясно, что выбор такого параметра находится всецело в руках исследователя. Так, время наблюдения, отраженное ядерно-цитоплазматическими константами, соответствует времени канонизации состояний клеточных множеств, персоналии же отражают состояние на момент наблюдения.
С целью выявления математического выражения оператора сдвигов состояния эпителиальных полей, образующих феномен 0.3-0.8, рассматривались различные гипотетические структурные схемы перехода клеточного субстрата из состояния отправления в состояние прибытия — параллельная и последовательная, в классе линейных систем. Позднее предположения линейности подтвердились на многих отражениях процесса, в частности — роста дегенеративности клеток. Были получены знаковые отношения соответствий параметров операторов преобразования патологическим состояниям субстрата, а само состояние озлокачествления, отразилось как результат срыва процесса регуляции ядерной мембраны в одиночной клетке. Это отражение было проверено специально поставленными экспериментами по оценке барьерных механизмов на животных (гематолабиринтный и гематоэнцефалический барьеры). Все эксперименты проводились в условиях вивария доктором мед. наук Исааком Маеровичем.
При решении уравнения идентификации в соответствии с теорией управления, были определены характеристики устойчивости переходных процессов озлокачествления (распределения корней характеристического уравнения). Оказалось, что переходные процессы из состояния нормы в пластическое состояние, устойчивы и обратимы, ибо для сдвига, в состояние прибытия, которым является дисплазия, корни характеристического уравнения остались в левой полуплоскости плоскости корней характеристического уравнения. Следовательно, гиперпластические клетки этого состояния, хотя и активированные, не должны рассматриваться как клетки канонического состояния, но только как стремящиеся в него. Сдвиги из всех других состояний, приводят к экспоненциальной неустойчивости процесса. Это означает, что эффект от терапии для этих состояний, ожидать вряд ли приходиться.
Для оценки свойств сохранения устойчивости системой регуляции ЯЦИ, были вычислены ее реакции по трем состояниям клеточного поля на входное воздействие типа дельта-функции — т.н. "импульсные переходные функции". Устойчивая система при таком воздействии тем или иным путем возвращается в начальное состояние, неустойчивая получает сколь угодно большие приращения выходного параметра.
Отклонения расчетных значений от данных клиники показали, что для процесса ND они практически совпадают на всем интервале физических возможностей существования ЯЦИ. Для процессов DCa и NCa расчетные и клинические данные полностью совпадают на участке значений индекса от 0.13 до 0.84.
Контрольная проверка точности определения переходных функций, как ядра преобразования, показывает их достаточно высокую достоверность. Характер переходных процессов позволяет подтвердить предположения об обратимости состояния пластичности в состояние покоя, при организации внешних управляющих воздействий, направленных на восстановление устойчивости регуляции ядерной проницаемости. Экспоненциальная неустойчивость процессов перехода из подсостояния гиперплазии состояния дисплазии в рак, таких надежд не оставляет.
Значение абсциссы максимума переходного процесса ND в 36% клеток, не сдвигается вправо от значения ядерно-цитоплазматического отношения, равного 0.13÷0.15 (соответствующего эпителиальной константе) и процесс полностью затухает в интервале [0.7-0.8]. Отсюда следует важнейший практический вывод: развитие процессов гиперпластичности в дисплазионном состоянии эпителии, должно быть (и может быть!) приостановлено до потери процессом устойчивости, т.е. до достижения, хотя бы, одной клеткой значения ядерно-цитоплазматического отношения, близкого к 0,8. Важно, что плотность вероятностей для гиперпластического подсостояния дисплазионного эпителия, также не отражает наличия хотя бы одной клетки с этим значением индекса. Видимо, это подсостояние дисплазии и образует состояние предрака, причем по значению моды распределения по персоналиям, можно говорить о степени его приближения к каноническому состоянию. Из этого следует и другой вывод — о непрерывном текущем контроле ядерно-цитоплазматической константы и возможности, на начальных этапах заболевания, целенаправленного контролируемого управления его изменениями.
Анализ переходных процессов показывает, что коэффициент затухания процесса, для сдвига в гиперпластическое состояние, выраженный в единицах изменения ядерно-цитоплазматического отношения и оказавшийся равным ~1,017, превосходит его теоретическое оптимальное значение, равное 0,707. Такое отклонение в большую сторону для устойчивого, а, следовательно, регулируемого процесса, с позиций теории регулирования может быть объяснено усилением на этом этапе процессов аварийного регулирования как защитной функции организма. Что касается процессов DCa, NCa, то затухание в них отсутствует (передаточная функция, хотя и выписывается формально, но физически для этих процессов не существует). Это позволяет высказать следующее важное предположение: развитие процесса трансформации (малигнизации) эпителиального поля, является следствием скачкообразного изменения защитных свойств аварийного процесса регуляции, феномен которого наблюдается на уровне клетки.
Получение импульсных переходных функций, позволило отобразить динамические отношения между соответствующими передаточными функциями преобразования в форме обобщенной математической модели регуляции ядерно-цитоплазматического отношения на множествах клеток эпителиального поля, как результата срыва аварийного регулирования ядерной проницаемости. Модель отражает динамику изменения вероятных значений ядерно-цитоплазматического отношения клеточного поля по относительной частоте его появления (частости) при переходах клеточного поля из состояния покоя в состояние пластичности, от него — в состояние гиперпластичности и далее в рак.
Существует еще один факт, который должен быть обсужден. Можно предположить, что распределение частости значений ядерно-цитоплазматического отношения ракового эпителия, представляющее собой зеркальное отображение распределения частости для дисплазии, но с особенностью в виде дельта--функции, связано с тем, что биофизические и биохимические процессы, происходящие в клетке на всех стадиях ее трансформации, сохраняют одну и ту же физическую природу, но меняют, на клеточном уровне, свои характеристики, определяемые процессами внутриклеточного обмена. Изменение таких характеристик может быть связано с нарушениями чувствительного к внешним возмущениям процессов регуляции, транспорта через барьеры. Особенности этих распределений явились источником отражения статистической "левизны-правизны" значениями коэффициентов в выражениях аппроксимации экспериментальных данных, симметричностью коэффициентов в выражениях операторов сдвигов и процессов трансформации, а также переброской корней характеристических уравнений в правую полуплоскость плоскости корней.
Это — вторичное отражение потери устойчивости процессами регуляции ядерно-цитоплазматического отношения при переходах DCa в рак из состояния гиперпластичности и в рак NCa из состояния покоя. Именно феномен срыва устойчивости регуляции ядерно-цитоплазматического отношения порождает антагонистический ему феномен порождения мультиустойчивости процесса роста размножающихся клеточных популяций.
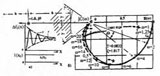
Был также определен годограф клеточного транспорта, который в соответствии с теорией управления, полностью отражает динамику изменения состояний эпителиального поля, являясь его исчерпывающей динамической характеристикой (заглавный рисунок). Годограф, в частности показывает, что различным степеням состояния пластичности эпителия соответствует изменение мощности множества клеток от относительного значения ок.20.2 до 93.7%, причем первую из этих величин можно рассматривать как индикатор возникновения процесса инициализации и возникновения пластичности, а вторую — как индикатор завершения этого процесса и перехода в состояния гиперпластичности — озлокачествления. Это означает, что подвижность эпителия, реализуемая транспортом из состояния покоя в состояние гиперпластичности, охватывает 97% клеток, прошедших путь от состояния инициализации до состояния гиперпластичности, в то время, как из состояния покоя в состояние инициализации происходит транспортировка приблизительно 20% клеток. Это может свидетельствовать о том, что мощность множества озлокачествляемых клеток нарастает в результате возбуждения клеточных множеств покоя внешними относительно этих клеток воздействиями, например — от подмножеств клеток-активаторов, так же и в состояниях Promotion и Progression. Отношение мощностей множеств клеток состояния прибытия, к мощности множеств клеток состояния отправления при одних и тех же значениях цитоплазматическо-ядерного индекса — аргумента 1/x годографа (обратного ЯЦИ), имеет характер текущего показателя степени озлокачествления, — эффективности клеточного транспорта. Градиент изменения значений этого показателя в единицах 1/x, отражает интенсивность процесса, а сама величина 1/x, формальный аналог аргумента 1/t для процессов, динамика которых рассматривается в пространстве времени.
На годографе также, в значениях цитоплазматическо-ядерного индекса 1/x, отсчитывается накопленная атипия. Диапазон ее значений ограничен величиной ~6.66, соответствующей константе состояния покоя, и точкой канонизации процесса, где она равна 1.25. Отсчет приращений атипии может производиться на любых ее интервалах. Накопление атипии происходит на интервале, соответствующем приращению цитоплазматическо-ядерного индекса, равном ~5.40, в то время, как состояние покоя сохраняется на интервале 13.34. Это указывает на быстротечность процесса накопления атипии. Форма годографа отражает колебательную устойчивость процесса транспорта. Возникнув в результате срыва регуляции ядерной проницаемости, процесс завершается транспортом подмножества мощностью в 13% от общего числа клеток в состояние прибытия — "голые ядра", из которого, в свою очередь, полное множество голых ядер физически агрегируется в "раковые жемчужины".
Годограф отражает большие запасы устойчивости процессов, которые зависят от формы охватывающей кривой и ее положения относительно особой точки (-1, j0) на левой полуплоскости мнимого переменного. Годограф показывает, что срыв устойчивости возникшего процесса озлокачествления, не осуществим из-за ее, практически не ограниченных, запасов. Особая точка годографа, характеризующая устойчивость, лежит внутри области физической недостижимости, процесс озлокачествления мультиустойчив.
Такие защитные средства сохранения можно рассматривать как собственные свойства канцерогенеза, изначально "заложенные" в его механизмы. Необратимая устойчивость процессов клеточного транспорта, отраженного в рост ядерно-цитоплазматического индекса, образуют механизм естественной самозащищенности и системной надежности, отчетливо проявляющихся в феномене рецидива роста опухоли даже из одиночных клеток, не удаленных в ходе операции.
Интересна еще одна характеристика процесса — "постоянная малигнизации", играющая роль постоянной времени и характеризующая быстродействие переходных процессов озлокачествления. Эта величина отражает стартовое значение ядерно-цитоплазматического отношения не просто как характеристики состояния (покоя), но и как параметра клеточного транспорта. Она оказалась достаточно близкой к половине значения эпителиальной константы и равной ~0.0832 и четко просматривается на решетке множеств, находясь в ближайшей окрестности узла < 0.05,I > первичного стартового множества состояния INITIATION, положившего начало формированию множества клеток баланса эквивалентности.
Можно предположить, что разница примерно в 10% между удвоенным значением этой постоянной и значением ЯЦИ эпителиальной константы в окрестностях (справа) значения 0.15, как порогового значения состояния покоя, связана с процессами "предстартовых операций" инициализации. Такие операции, как показывает анализ, подготавливают условия для накопления минимального стартового клеточного множества, запускающего процесс инициализации, и отправляющегося из состояния покоя в состояние пластичности. Стартовый переход реализует инициальный запуск в виде "переключения" стартового множества клеток на транспорт. Первичное стартовое множество — переключающее. В процессе такого переключения могут осуществляться информационные процедуры преемственности — передачи тех или иных ролевых функций клетками, покидающими состояние отправления, молодым клеткам остающимся или поступающим в первичное предстартовое состояние, как в состояние прибытия.
Константа малигнизации — параметр, существенно определяющий древесный рост опухоли, отражается в показатели активности клеточного множества баланса эквивалентности. Совместно с множеством динамических параметров процесса озлокачествления, как феномена "0.3-0.8", она находится в отношении взаимного отражения с древесным ростом.
Яков Гельфандбейн, Борис Каплан
(c) 1011494 CIPO



